Wasserstoffspektrum: Lösung
(1) 1897 ordnete E. Pickering das Spektrum eines Sterns aufgrund seiner Spektralserie dem Wasserstoff zu. Er hatte folgende Spektrallinien gefunden: 656 nm, 486 nm und 434 nm. Allerdings gab es noch zwei weitere Linien: 541 nm und 456 nm. Stellen Sie eine Hypothese auf, woher diese Linien stammen könnten.
Die Linien stammen von einfach ionisierten Helium-Atomen.
(2) Die von J. Balmer im Jahre 1885 gefundene Formel beschreibt eine Gesetzmäßigkeit für eine Serie von Linien des Wasserstoffspektrums.
a. Berechnen Sie die Wellenlänge der ersten nicht mehr sichtbaren Balmerlinie (liegt unterhalb von 400nm).
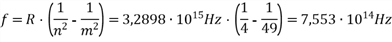
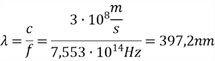
b. Auf Wasserstoffgas treffen Photonen der Energie 2,5 eV. Dadurch wird ein Atom, dessen Elektron sich auf der 2. Quantenbahn befindet, weiter angeregt. Begründen Sie, auf welche Quantenbahn das Elektron angehoben wird.
Aus dem Termschema entnimmt man die Energiedifferenz zwischen der zweiten und vierten Bahn: Es sind 2,5 eV. Es gibt nur diesen Übergang, da die Photonen ihre Energie nur vollständig an das Atom abgeben können.
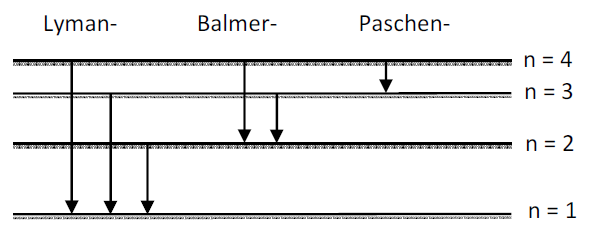
c. Ein auf n = 4 angeregtes Wasserstoffatom kann verschiedene Spektrallinien emittieren. Zeichnen Sie die möglichen Übergänge in ein Termschema ein.
d. Wenn Elektronen, deren Energie mindestens 2,11 eV beträgt, auf Natriumdampf treffen, kann man mit einem Spektroskop das Auftreten einer Spektrallinie beobachten. Erklären Sie die Erscheinung, und berechnen Sie die Wellenlänge der Linie.
Da die Elektronen inelastisch mit den Natrium-Atomen stoßen, geben sie Ihre Energie vollständig an die Na-Atome ab. Dadurch wird ein Elektron in ein 2,11 eV höheres Energieniveau gehoben (über dem Grundzustand). Beim Zurückfallen in den Grundzustand, werden Photonen der Energie 2,11 eV abgestrahlt:
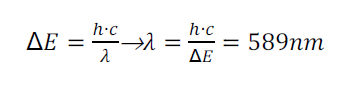
(3) Aufgrund der Beobachtung optischer Spektren kann man schließen, dass Atome Energie nur in bestimmten Portionen abgeben.
a. Zeigen Sie mithilfe einer beschrifteten Skizze, wie man ein solches Spektrum erhält. Erläutern Sie, welche Beobachtung auf die quantisierte Energieabgabe schließen lässt.
Durch ein Gitter beobachtet man eine Spektralröhre, deren Gas durch Stöße mit Elektronen zum Leuchten angeregt wird. Links und rechts des Maximums 0.Ordnung beobachtet man die Maxima höherer Ordnung. Da der Beugungswinkel von der eingestrahlten Wellenlänge abhängt, beobachtet man an verschiedenen Orten farbige Linien. Die scharf begrenzten Linien des beobachteten Spektrums lassen auf diskrete Werte der Wellenlängenschließen und daraus auf die quantisierte Energieabgabe.
b. Berechnen Sie die minimal notwendige kinetische Energie der stoßenden Elektronen, um H-Atome aus dem Grundzustand in den dritten Quantenzustand anheben zu können.
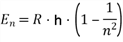
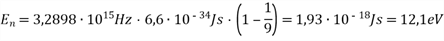
c. Die in Teilaufgabe b. angeregten Atome senden Lichtquanten verschiedener Energie aus. Berechnen Sie die entsprechenden Wellenlängen.
Die Wellenlänge kann man berechnen mit:
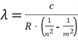
Es gibt drei mögliche Energieübergänge:
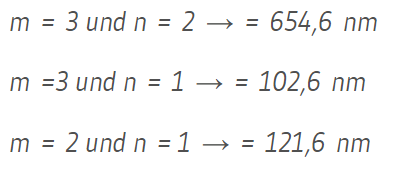
Wasserstoffspektrum: Lösung: Herunterladen [docx][119 KB]
Wasserstoffspektrum: Lösung: Herunterladen [pdf][138 KB]
Weiter zu Die Hubble-Beziehung
