Arbeitsblatt: Elektronenabstände zum Kern
Kompetenzen:
| Inhalt | pbK | ibK |
| Die Ionisierungsenergien bei Atomen einer Periode lassen sich gut vergleichen, da die Abstände Elektron-Kern vergleichbar groß sind. Je größer die Kernladung, desto höher ist die Ionisierungsenergie und desto kleiner ist der Abstand. | 2.1.13 ihr physikalisches Wissen anwenden, um Problem- und Aufgabenstellungen zielgerichtet zu lösen 2.2.2 funktionale Zusammenhänge zwischen physikalischen Größen verbal beschreiben (zum Beispiel „je-desto“-Aussagen) 2.2.6 Sachinformationen und Messdaten aus einer Darstellungsform entnehmen |
3.3.1 (3) die Funktion von Modellen in der Physik erläutern (anhand des Teilchenmodells und der Modellvorstellung von Atomen) 3.3.4 (1) die Struktur der Materie im Überblick beschreiben und den Aufbau des Atoms erläutern (Atomhülle, Atomkern, Elektron, Proton, Neutron, Quarks, Kernladungszahl, Massenzahl, Isotope) |
Voraussetzungen:
Chemie 3.2.1.2 (1) Atome, Moleküle und Ionengruppen als Stoffteilchen beschreiben
- Die Kraft zwischen einem Elektron und dem Kern hängt entscheidend von deren Abstand ab.
- Bei geringem Abstand zwischen den Objekten, d. h. bei größerer Anziehungskraft, benötigt man mehr Energie, um die Objekte wieder vollständig zu trennen, als wenn diese weit auseinander sind.
Ziele:
- Den Zusammenhang zwischen der Größe der Ionisierungsenergie und dem Abstand zwischen dem betreffenden Elektron und Kern erkennen.
- Die Abschirmung der Kernladung durch die nahe am Kern befindlichen Elektronen erkennen.
- Abstoßende Kräfte unter den Elektronen berücksichtigen.
- Deutliche Unterschiede in den jeweiligen Abständen zum Kern können festgestellt werden.
Problemstellung:
Welchen Abstand zum Kern haben die Elektronen im Atom?
Die folgende Grafik zeigt die Ionisierungsenergien aller Elektronen der Atome Natrium (Z=11), Magnesium (Z=12) und Aluminium (Z=13).
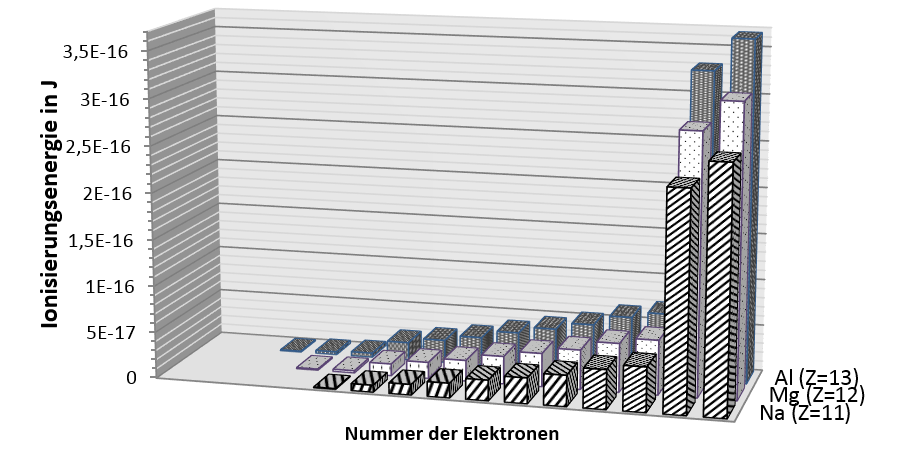
Datenquelle: http://www.periodensystem.info/elemente vom 2.3.2017
Aufgaben:
- Vergleiche die Verläufe der Ionisierungsenergien bei diesen 3 verschiedenen Atomen und stelle Gemeinsamkeiten heraus.
- Gib an, nach wie vielen Elektronen es jeweils zu deutlichen Sprüngen in der Ionisierungsenergie kommt.
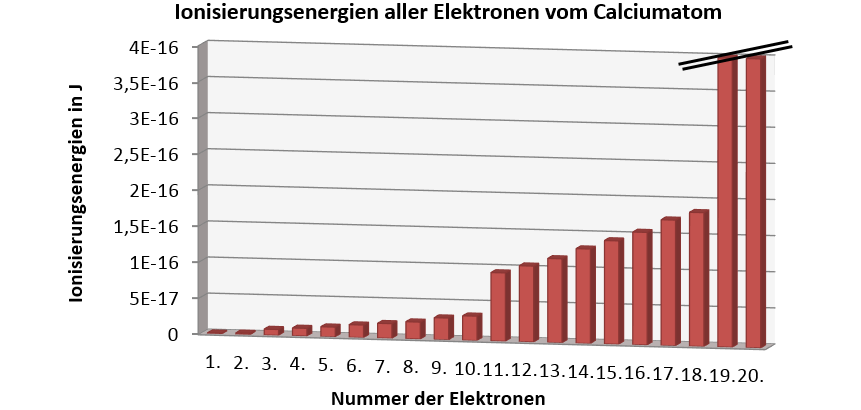
Datenquelle: http://www.periodensystem.info/elemente vom 2.3.2017
- Beschreibe den Verlauf der Ionisierungsenergien und erläutere, worin sich aufgrund dieser Daten ein Calciumatom von den oben behandelten Atomen unterscheidet.
Arbeitsblatt: Elektronenabstände zum Kern: Herunterladen [docx][33 KB]
Weiter zu Größe der Atome
