Arbeitsblatt: Größe der Atome
Kompetenzen:
| Inhalt | pbK | ibK |
| Die Ionisierungsenergien bei Atomen mit steigender Kernladungszahl wachsen an. Aus diesen Daten können die Größen der Atome vergleichen werden. | 2.1.2 Hypothesen zu physikalischen Fragestellungen aufstellen 2.1.11 mithilfe von Modellen Phänomene erklären und Hypothesen formulieren 2.1.13. ihr physikalisches Wissen anwenden, um Problem- und Aufgabenstellungen zielgerichtet zu lösen 2.2.2 funktionale Zusammenhänge zwischen physikalischen Größen verbal beschreiben (zum Beispiel „je-desto“-Aussagen) 2.2.6 Sachinformationen und Messdaten aus einer Darstellungsform entnehmen |
3.3.1 (3) die Funktion von Modellen in der Physik erläutern (anhand des Teilchenmodells und der Modellvorstellung von Atomen) 3.3.4 (1) die Struktur der Materie im Überblick beschreiben und den Aufbau des Atoms erläutern (Atomhülle, Atomkern, Elektron, Proton, Neutron, Quarks, Kernladungszahl, Massenzahl, Isotope) |
Voraussetzungen:
Chemie 3.2.1.2 (1) Atome, Moleküle und Ionengruppen als Stoffteilchen beschreiben
- Die Kraft zwischen einem Elektron und dem Kern hängt entscheidend von deren Abstand ab.
- Bei geringem Abstand zwischen den Objekten, d. h. bei größerer Anziehungskraft, benötigt man mehr Energie, um die Objekte wieder vollständig zu trennen, als wenn diese weit auseinander sind.
Ziele:
- Den Zusammenhang zwischen der Größe der Ionisierungsenergie und dem Abstand zwischen dem betreffenden Elektron und Kern erkennen.
- Mit steigender Kernladung wird die Anziehung größer und die Abstände zwischen den Elektronen und dem Kern kleiner.
- Die Größe der Atome nimmt i.d.R. innerhalb einer Periode mit wachsender Kernladungszahl ab.
- Die äußeren Elektronen tragen wegen ihrer nur geringen Bindung zur chemischen Reaktivität des Atoms bei.
Problemstellung:
Sind verschiedene Atome gleich groß?
Die folgende Grafik zeigt die Ionisierungsenergien jeweils aller Elektronen der Atome Natrium (Na) bis Phosphor (P).
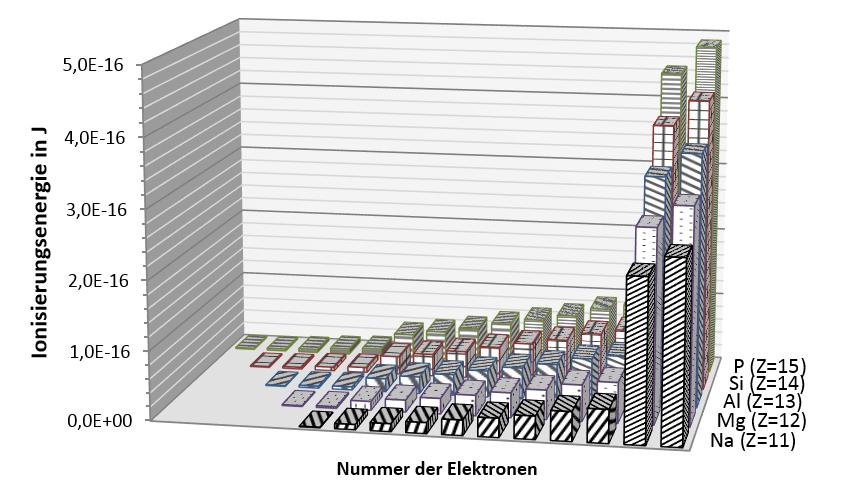
Datenquelle: http://www.periodensystem.info/elemente vom 2.3.2017
Aufgaben:
- Vergleiche die Verläufe der Ionisierungsenergien bei diesen verschiedenen Atomen und stelle Gemeinsamkeiten und Unterschiede heraus.
- Erkläre den Anstieg der Werte für die beiden Elektronen mit den jeweils höchsten Ionisierungsenergien von Natrium- bis zum Phosphoratom.
- Stelle begründet eine Hypothese auf, wie sich die Größe der Atome von Natrium bis Phosphor ändern wird.
- Erläutere, welche Vermutung über die Elektronen naheliegt, für die nur eine sehr geringe Ionisierungsenergie aufgewendet werden muss.
- Erläutere, warum gerade die Elektronen mit sehr geringer Ionisierungsenergie für chemische Reaktionen wichtig sind.
Arbeitsblatt: Größe der Atome: Herunterladen [docx][33 KB]
Weiter zu Lösungen
