Themenbox II
Die Stoffeigenschaften von Salzen lassen sich sehr gut über das Vorhandensein von Ionen erklären. Aber wie kam man auf diese Modellvorstellung, deren Ergebnisse letztendlich im Periodensystem der Grundbausteine zusammengefasst dargestellt sind? Wie lässt sich die Entstehung der unterschiedlichen Ionen erklären?Reaktiviere Dein Wissen

Beschreibe was diese Merkhilfe besagt:

Nenne die Stoffteilchen der Edelgase Helium und Xenon.

Edelgasregel und Ionenbildung
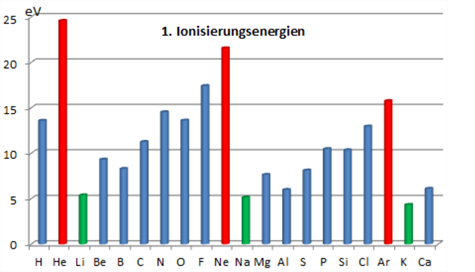
Die Edelgase haben bereits seit Klasse 8 eine besondere Stellung im Chemieunterricht. Die unreaktiven Gase bestehen im Gegensatz zu den anderen flüchtigen Stoffen aus einzelnen Atomen und nicht aus Molekülen. Von Edelgasen sind auch keine Ionenverbindungen bekannt. D.h. sie bilden mit Metallen keine Salze. Bei dem Vergleich ihrer Elektronenverteilung wird deutlich, dass alle Edelgasatome 8 Elektronen auf dem äußeren Energieniveau aufweisen. Eine Ausnahme bilden Heliumatome, hier sind es 2 Elektronen.Der Betrag der 1.Ionisierungenergie fällt bei den Edelgasen ebenfalls sehr hoch aus (rot) und lässt darauf schließen, dass die Elektronenverteilung der Edelgasatome zu sehr stabilen Teilchen führt. Man nennt dies die Edelgasregel.
Zusatzinformationen:
Periodensystem verändert nach: http://chemischdenken.de/wp-content/uploads/2017/06/Didaktisches-Periodensystem-der-Elemente_2017-03-21eco.pdf .
|

Möchtest Du mehr über Edelgase wissen? Hier erfährst Du mehr: YouTube-Video "Simple Chemics - Edelgase" (5min)
|
LernBox: Atomhülle genauer betrachtet: Herunterladen [docx][2 MB]
LernBox: Atomhülle genauer betrachtet: Herunterladen [pdf][2 MB]
Weiter zu Aufgabe 4
