Kurzpraktikum
Neuer Chemielaborant bringt Un-Ordnung ins Labor (2)
Weyrus hat festgestellt, dass die Chemikalienflaschen, die er neu geordnet hat, von außen sehr verschmutzt sind.
Er will nun anfangen sie zu säubern und stellt drei Flaschen (Ethanol, Ethansäure und Heptan) schon mal in eine Wanne mit Wasser, um die Verschmutzungen erst einmal aufzuweichen. Nach kurzer Zeit sieht er, dass sich die Schilder, auf denen die Stoffnamen stehen, abgelöst haben und nun auf dem Wasser schwimmen.
AUFGABE: Hilf Weyrus, die Schilder wieder den richtigen Stoffen zuzuordnen. Du hast zur Verfügung
- 3 Schnappdeckelgläschen mit jeweils einer kleinen Probe der 3 Stoffe (beschriftet mit 1, 2, 3)
- Tüpfelplatte mit wenigen Kristallen eines farbigen Salzes in 3 Vertiefungen
- 4 Pipetten
- Universalindikatorpapier.
Plane zuerst deinen Versuch und besprich ihn VOR der Durchführung mit deinem Lehrer (Tipp: Überprüfe auch das Verhalten des Salzes gegenüber Wasser).
Wenn du nicht weiter weißt, kannst du dir Hilfen beim Lehrer holen. Schreibe ein Versuchsprotokoll.
B: Salz löst sich in Wasser!
D |
B - Glas 1 |
B - Glas 2 |
B - Glas 3 |
+ UIP |
rot |
- |
- |
+ Salz |
Löst sich |
Löst sich |
Löst sich nicht |
E |
Ethansäure |
Ethanol |
Heptan |
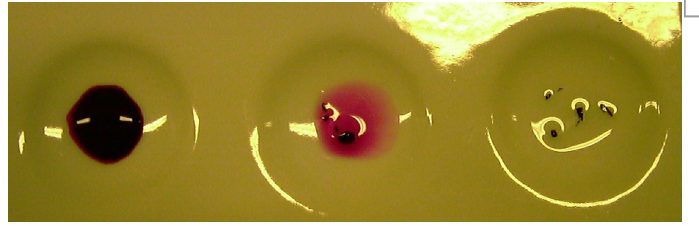
E: Universalindikator zeigt Säuren bzw. saure Lösungen durch rote Färbung an.
Salze bestehen aus Ionen, den positiv geladenen Kationen und den negativ geladenen Anionen, diese ziehen sich aufgrund ihrer unterschiedlichen Ladung stark an und es kommt zur Ionenbindung. Hierbei handelt es sich um eine sehr starke Bindung, d.h. zwischen den Ionen herrschen starke Anziehungskräfte, Salze sind daher Feststoffe.
Heptan besteht aus unpolaren Molekülen. Zwischen ihnen bestehen nur Wechselwirkungen zwischen temporären Dipolen. Diese sind bei den "mittelgroßen" Heptan-Molekülen "mittelstark". Infolgedessen ist Heptan eine Flüssigkeit (und nicht wie die niederen Alkane ein Gas).
Ethanol besteht aus polaren Molekülen. Es besitzt durch die OH-Gruppe einen polaren und durch die CH3-Gruppe einen unpolaren Molekülteil. Zwischen Ethanol-Molekülen bestehen Wechselwirkungen zwischen temporären Dipolen und H-Brücken, diese sind so stark, dass Ethanol eine Flüssigkeit ist.
Salze lösen sich in Wasser, weil die Wasser-Dipole die starke Ionenbindung überwinden und die Ionen aus ihrem Verband lösen können. D. h. die Ionen und die Wasser-Dipole ziehen sich stärker an, als die Wasser-Moleküle untereinander (durch H-Brücken) und die Ionen untereinander (durch Ionenbindung).
Salze lösen sich in Ethanol, weil die polaren Ethanol-Moleküle die starke Ionenbindung überwinden und die Ionen aus ihrem Verband lösen können. D. h. die Ionen und die Ethanol-Moleküle ziehen sich stärker an, als die Ethanol-Moleküle untereinander und die Ionen untereinander. Salze lösen sich allerdings besser in Wasser als in Ethanol, da Wasser-Moleküle stärker polar sind als Ethanol-Moleküle.
Salze lösen sich nicht in Heptan, weil die Ionenbindung zwischen den Ionen des Salzes und die Wechselwirkungen zwischen permanenten Dipolen der Ethanol-Moleküle untereinander jeweils stärker sind als die WW, die zwischen den Heptan-Molekülen und den Ionen des Salzes wirken.
Kurzpraktikum: Herunterladen [docx][160 KB]
Kurzpraktikum: Herunterladen [pdf][503 KB]
Weiter zu GBU
