Tandembogen: Ionenbindung – Elektronenpaarbindung
Bindungen innerhalb von Stoffteilchen
Das weiß ich schon:
Die Atome aller Elemente haben das Bestreben, eine Edelgaskonfiguration zu erreichen, d.h. die Kugelwolken in der äußeren Schale sind mit Elektronen voll besetzt.
→ Es gibt zwei Möglichkeiten, wie Atome die Edelgaskonfiguration erreichen können.
Möglichkeit 1:
Nichtmetall-Atome teilen sich ein bindendes Elektronenpaar: Die einfach besetzten Kugelwolken überlappen, zwischen den Atomen entsteht eine Elektronenpaarbindung.
→ Es entstehen Moleküle. Beispiel:
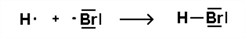
Möglichkeit 2:
Metall-Atome geben Elektronen ab (Oxidation), Nichtmetall-Atome nehmen Elektronen auf (Reduktion).
Aus den neutralen Atomen werden elektrisch geladene Teilchen: Ionen. Die Bindung zwischen Ionen wird als Ionenbindung bezeichnet.
→ Es entstehen Ionen. Beispiel:
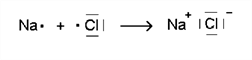
→ Check dein Wissen zu den chemischen Bindungen, dann geht´s weiter!
Das lerne ich jetzt:
Die Stoffteilchen von Metallen sind Atome im Atomverband.
→ Wie sind Metall-Atome aneinander "gebunden"? Wie entsteht der Atomverband? Wie erreichen Metall-Atome im Atomverband eine Art "Edelgaskonfiguration"?
→ Wie lassen sich die gute elektrische Leitfähigkeit und die Verformbarkeit erklären?
Wissenscheck: Chemische Bindungen – Das weiß ich schon…
Faltet das Blatt längs entlang der Mittellinie. Jeder Schüler sieht nur eine Seite des Tandembogens.
Schüler 1 liest die fettgedruckte Aufgabe laut vor und beantwortet sie. Schüler 2 kontrolliert mithilfe der Lösung, hilft und korrigiert.
|
Nenne und erkläre die Edelgasregel. |
Jedes Atom strebt eine Edelgaskonfiguration an, d.h. die äußere Schale ist voll besetzt (enthält 8 Elektronen bzw. die K-Schale enthält 2 Elektronen) |
|
Metall-Atome geben ihre Außenelektronen ab, dadurch werden sie zu positiv geladenen Kationen. |
Erkläre, wie aus Metall-Atomen die entsprechenden Metall-Ionen werden können. |
|
Definiere Oxidation, Reduktion und Redoxreaktion |
Oxidation: Abgabe von Elektronen Reduktion: Aufnahme von Elektronen Redoxreaktion: Reaktion, bei der Elektronen aufgenommen und abgegeben werden. |
|
Calciumbromid enthält die Ionen Ca2+ und Br -. Damit die Ionengruppe insgesamt elektrisch neutral ist, ist die Verhältnisformel CaBr2 |
Gib die Verhältnisformel von Calciumbromid an. |
|
Aus welchen Ionen ist Eisenoxid aufgebaut, wenn die Verhältnisformel Fe2O3 lautet? |
Oxid-Ion O2-; damit kann man die Ladung der Eisen-Ionen berechnen: Fe3+. |
|
a) Ein Metall ragiert mit einem Nichtmetall zu einem Salz. b) Nichtmetall-Atome verbinden sich zu Molekülen. |
Entscheide, ob bei der Reaktion Ionen oder Moleküle entstehen und begründe: a) Kupfer reagiert mit Schwefel b) Sauerstoff reagiert mit Schwefel |
|
Erkläre das Zustandekommen einer Elektronenpaarbindung. |
Zwei einfach besetzte Kugelwolken überlappen/durchdringen sich, die beiden beteiligten Atome erreichen durch ein gemeinsames bindendes Elektronenpaar die Edelgaskonfiguration. |
|
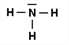 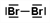 |
Gib die Strukturformel eines Brom-Moleküls (Br2) und eines Ammoniak-Moleküls (NH3) an. |
|
Gib die Strukturformel eines Moleküls mit einer Mehrfachbindung an. |
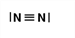 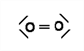 |
|
NaBr: Es handelt sich um ein Salz, das aus Ionen aufgebaut ist, daher liegt eine Ionenbindung vor (und ΔEN (NaBr) = 1,9) HBr: Es handelt sich um eine polare Elektronenpaarbindung (ΔEN (H-Br) = 0,7) Br2: Es handelt sich um eine unpolare Elektronenpaarbindung (ΔEN (Br-Br) = 0) |
Gegeben sind die chemischen Formeln Stoffteilchen: Bestimme die Art der chemischen Bindung exakt und begründe: NaBr , HBr , Br2 |
Tandembogen: Ionenbindung – Elektronenpaarbindung: Herunterladen [docx][178 KB]
Tandembogen: Ionenbindung – Elektronenpaarbindung: Herunterladen [pdf][510 KB]
Weiter zu Prezi-Präsentation: Stoffliche Welt
