Arbeitsblatt 8: Mutation ist nicht gleich Mutation
Diese Seite als PDF herunterladen [PDF] [122 KB]
Arbeitsblatt 8: Mutation ist nicht gleich Mutation
Mutationen können eine Zelle aus dem physiologischen Gleichgewicht bringen, weil sich dadurch beispielsweise die Menge oder Aktivität produzierter Proteine ändert.
Bei zwei Klassen von Genen, die für das normale Zellwachstum, die Zellteilung und die Zelldifferenzierung wichtig sind, können Mutationen gravierende Folgen haben. Es handelt sich um: a) Proto-Onkogene (= Krebsgen-Vorläufer) und b) Tumorsuppressorgene (= tumor-unter-drückende Gene).
Proto-Onkogen:
Im häufigsten Fall führen Mutationen in Proto-Onkogenen zu einem Funktionsverlust des entsprechenden Proteins. Folge: die Zellteilung wird nicht mehr gefördert und die Zelle kann sich nicht mehr teilen. Meist zieht das eine Apoptose nach sich, was für den Organismus kein Problem darstellt, da sich normalerweise genügend andere teilbare Zellen in der Nachbarschaft befinden. Proto-Onkogene können durch Mutationen jedoch auch in eine krebserzeugende Form (= Onkogen) verwandelt werden. Es sind mehr als 100 Proto-Onkogene bekannt (Stand: 2004).
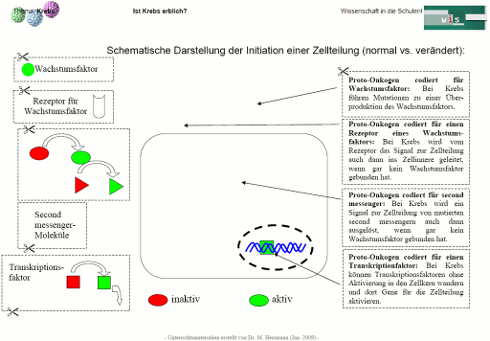
Die Proteine, die von Proto-Onkogenen codiert werden, haben im normalen Zustand einen wachstumsfördernden Einfluss auf Zellen und kontrollieren den Zellzyklus. Alle Zellzyklus-Kontrollgene sind potenzielle Proto-Onkogene, da ihre Veränderung bzw. Fehlfunktion den Verlust der Kontrolle über die Zellteilung bedeuten kann.
So haben sie z.B. die Aufgabe als Wachstumsfaktor Zellen zur Teilung anzuregen, als Andockstelle auf der Zelloberfläche (= Rezeptor) Wachstumsfaktoren zu binden, bei der kaskaden-artigen Signalweiterleitung von Zelloberfläche zum Zellkern mitzuwirken oder direkt als Transkriptionsfaktor im Zellkern die Expression bestimmter Gene zu steuern.
Beispiele zellulärer Proto-Onkogene:
|
Typ
|
Name/Abkürzung
|
Vom Proto-Onkogen
zum Onkogen
|
mögl.
Tumor
|
| Wachstumsfaktor | EGF (epidermal growth factor) | durch Überexpression dauerhafte Aktivierung der Rezeptoren |
verschieden
|
|
Rezeptor für
Wachstumsfaktor
|
EGF-R (epidermal growth factor receptor) | durch Uberexpression oder Veränderung der Bindungsdomäne dauerhafte Aktivierung des second-messenger-Mechanismus |
z.B. Brustkrebs
|
| Signaltransduktion im Cytoplasma | ras (rat sarcoma; ein GTP-bindendes Enzym) | durch Mutation sind die Enzyme daueraktiv | Lungen-, Dickdarmkrebs |
| Transkriptionsfaktor |
myc
|
durch Mutation ist die Interaktion mit anderen Proteinen u./od. der DNA verändert, wodurch die Regulation der Genexpression gestört wird | Lungen-, Brustkrebs, Lymphome |
Aufgaben:
- Erläutern Sie die Vorgänge innerhalb des Zellzyklus. Gehen Sie auf die verschiedenen Phasen ein.
- Man vergleicht die Funktion zellulärer Proto-Onkogene gerne mit dem Gaspedal eines Autos. Stellen Sie in einem Schema einer Zelle übersichtlich dar, auf welchen Ebenen die Zellzyklus-Kontrolle mutationsbedingt versagen kann (d.h. das Gaspedal klemmt in gedrücktem Zustand).
- Retroviren können nach Infektion einer Wirtszelle ihr virales Erbgut in die Wirts-DNA einbauen. Das Virusgenom enthält mutierte Versionen zellulärer Proto-Onkogene (so genannte v-Onkogene (v = viral)). Nennen Sie mögliche Auswirkungen einer retroviralen Infektion und erläutern Sie den Vorteil für das Virus.
Tumorsuppressorgen:
Die Proteine, die von Tumorsuppressorgenen codiert werden, haben im normalen Zustand einen wachstumshemmenden Einfluss auf Zellen. Bisher sind über 170 Tumorsuppressorgene bei Menschen und anderen vielzelligen Organismen bekannt.
Während bei Proto-Onkogenen die Mutation von einem der beiden Allele ausreicht, um es als Onkogen zu aktivieren, müssen bei Tumorsuppressorgenen beide Allele mutiert sein, damit das Tumorsuppressorprotein seine wachstumshemmende Eigenschaft verliert (Two-Hit-Hypothese). Letzteres kann auch als Grund herangezogen werden, weshalb Krebs eine Erkrankung der zweiten Lebenshälfte ist. Jedoch werden etwa 10% der Menschen mit einem mutierten Alle! für Tumorsuppressorgene geboren; sie haben eine vererbte Prädisposition für Krebs. Dies bedeutet beispielsweise für die 9% Frauen, die ein mutiertes Allel des Tumorsuppressorgens BRCA-1 geerbt haben, dass sie mit 60%-iger Wahrscheinlichkeit bis zum Alter von 50 Jahren und mit 82%-iger Wahrscheinlichkeit bis zum 70. Lebensjahr Brustkrebs entwickeln. Für Frauen mit zwei normalen Allelen des BRCA-1-Gens sind die Wahrscheinlichkeiten 2% bzw. 7%.
Beispiele zellulärer Tumorsuppressorgene:
|
Typ
|
Name/Abkürzung
|
Von normal zu mutiert
|
mögl.
Tumor
|
|
Zelladhäsions-molekül
|
DCC (deleted in colon carcinoma) | Verlust der Anheftung an Nachbarzellen | Dickdarmkrebs |
| DNA-Reparatur | BRCA-1, BRCA-2 (breast cancer) | Verlust der DNA-Reparaturfunktion | Brust-, Prostatakrebs |
| Kontrolle des Zellzyklus | p53 (Protein mit Molekülmasse von 53.000 y) | Zellteilung kann in G 1 -Phase des Zellzyklus nicht mehr angehalten werden | verschieden (bei über 50% aller menschl. Tumore) |
Tumorsuppressorgene haben die Aufgabe als Wachstumshemmer in Zellen Teilungen zu verhindern bzw. mutierte Zellen zu veranlassen, das Selbstmordprogramm (= Apoptose) zu starten. Eine Fehlfunktion ist mit einem Auto vergleichbar, bei dem die Bremse nicht mehr funktioniert.
Quellen (verändert Dez. 2008):
(1) Lexikon der Biologie, Spektrum Akademischer Verlag, Heidelberg, 2002
(2) Purves et al., Biologie, 7. Auflage, Eisevier GmbH, Spektrum Akademischer Verlag Heidelberg, 2006
(3) http://de.wikipedia.org/wiki/Onkogen
Glossar:
epidermal growth factor . Wachstumsfaktor, der an der Angiogenese, Wundheilung und während der Embryonalentwicklung beteiligt ist
GTP (Guanosintriphosphat): Baustein für DNA- und RNA-Synthese; energiereiches Stoffwechselprodukt (vgl. ATP)
Prädisposition : genetische Veranlagung, die die Entstehung einer Krankheit begünstigt
Weiterführende Literatur:
Chaos in der Erbsubstanz, Spektrum der Wissenschaft, Spezial 3: Krebsmedizin II, s. S. 12-22, 2003
Früherkennung und Diagnostik mit Tumormarkern, Spektrum der Wissenschaft, Spezial 2: Krebsmedizin, S. 47-52, 1996
Schematische Darstellung der Initiation einer Zellteilung (normal vs. verändert):