Arbeitsblatt 10: Zell-Gau Information
 Diese
Seite als PDF herunterladen
[PDF] [148 KB]
Diese
Seite als PDF herunterladen
[PDF] [148 KB]
Arbeitsblatt 10: Zell-Gau Information
Wie führt der Flügelschlag eines Schmetterlings zum GAU? - oder: Warum kann ein einzelnes Protein eine Zelle ins Chaos stürzen?
Das Tumorsuppressor-Protein p53 ist ein "Multitasker", der durch spezifische Bindung an DNA oder andere Proteine Vorgänge wie Apoptose, Zellteilung oder Angiogenese steuert. Wie kann p53 aus einer Vielzahl von Molekülen innerhalb der Zelle genau das Richtige auswählen? 1894 prägte der deutsche Chemiker EMIL FISCHER die Modellvorstellung vom "Schlüssel-Schloss-Prinzip" und umschrieb damit am Beispiel von Enzymen und ihren Substraten Molekülwechselwirkungen, die auf einem exakten Ineinandergreifen von Oberflächenformen und chemischen Gruppen beruht. Durch technische Neuerungen konnte nicht nur der direkte Beweis für die Richtigkeit von FISCHERS Hypothese beim Enzym-Substrat-Komplex geliefert werden; sie wird mittlerweile auch als Grundprinzip für alle spezifischen Interaktionen auf molekularer Ebene anerkannt (z.B. Antigen-Antikörper, Hormon-Hormonrezeptor, Zell-Zell-Adhäsion, Virusinfektion von Zellen).
Nach Kristallisation der Moleküle können mittels Röntgenstrahlen so genannte Beugungsmuster beobachtet werden, aus denen computergestützt die exakte räumliche Position jedes Atoms im Molekül berechnet werden kann (= Röntgen-strukturanalyse). Neben Sequenzdaten für Nukleinsäuren und Proteine vieler Organismen existieren mittlerweile Abermillionen von 3D-Strukturdaten, die am Computerbildschirm visualisiert werden können.
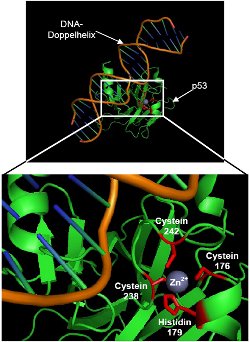
Bändermodell und Ausschnittvergrößerung
|
|
Bändermodell: Tumorsuppressorprotein p53 bindet spezifisch an DNA-Sequenz |
|
Vergrößerung: hellgrün: Darstellung der Sekundär-und Tertiärstruktur des p53-Moleküls ohne Seitenketten der Aminosäuren rot: Aminosäuren mit Seitenketten, die den Zinkfinger ausbilden; Zahl gibt die Position der Aminosäure im Protein an grau: Zink-lon (stabilisiert Konformation der Proteinregion) |
Zinkfinger : Struktur aus Cystein- und Histidinresten mit einem zentralen Zink-lon, die Proteinregion stabilisiert und zur spezifischen DNA-Bindung befähigt.