Praktikum: Redoxreaktionen zwischen Metallatomen und Metallkationen
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
Welche Metallkationen reagieren mit welchen Metallatomen?
Metalle sind unterschiedlich gut oxidierbar. Dabei geben die Metallatome Elektronen ab; sie wirken als Reduktionsmittel.
Als Reaktionspartner muss ein Oxidationsmittel die Elektronen aufnehmen. Das können zum Beispiel Kationen eines anderen Metalls sein, die dann zu Metallatomen reduziert werden.
Die Gesamtreaktion lässt sich mit einer Reaktionsgleichung darstellen, in der der Elektronenübergang gezeigt wird.
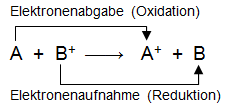
Setzt man einen Tropfen einer Salzlösung, die Kationen eines bestimmten Metalls enthält, auf einen blanken Streifen eines anderen Metalls, so kann man manchmal eine Metallabscheidung beobachten, manchmal aber auch nicht.
Mit diesem Praktikum sollen Sie herausfinden, bei welchen Kombinationen von Metallatomen/Metallkationen Redoxreaktionen freiwillig ablaufen und bei welchen nicht.
Materialien
| Blechstreifen 1,5 x 7,5 cm | Lösungen in Tropfflaschen (je c = 0,1 mol·L -1 ) |
| Eisenblech | Eisensulfat-Lösung (enthält Fe 2+ ) |
| Kupferblech | Kupfersulfat-Lösung (enthält Cu 2+ ) |
| Silberblech | Silbernitrat-Lösung (enthält Ag + ) |
| Zinkblech | Zinksulfat-Lösung (enthält Zn 2+ ) |
Aufgaben
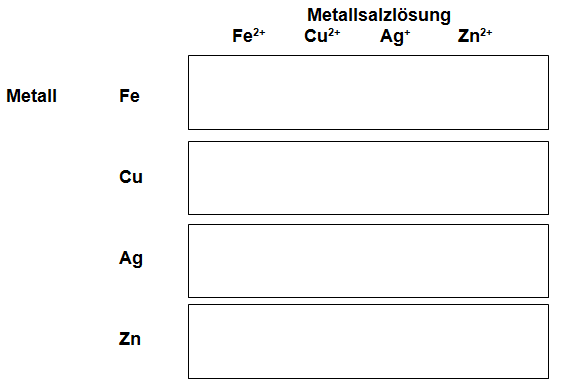
- Legen Sie die blanken Metallblechstreifen auf die gekennzeichneten Felder und geben Sie je einen Tropfen Salzlösung auf die Metalle.
- Beobachten Sie, wo es Veränderungen gibt.
- Formulieren Sie Reaktionsgleichungen für die Fälle, in denen offensichtlich Redoxreaktionen ablaufen.
- Ordnen Sie die korrespondierenden Redoxpaare Metallatom/Metall-Kation nach Stärke des Reduktionsmittels bzw. Oxidationsmittels in einer geeigneten Tabelle.
Praktikum: Redoxreaktionen zwischen Metallatomen und Metallkationen: Herunterladen [doc] [58 KB]
Praktikum: Redoxreaktionen zwischen Metallatomen und Metallkationen: Herunterladen [pdf] [84 KB]
