Lehrerinformation
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
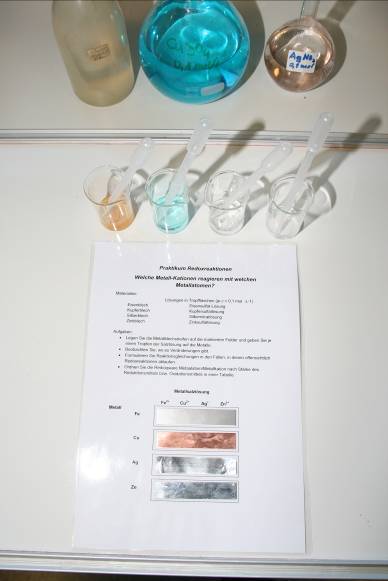
Ein Schülerversuch mit gut reproduzierbaren Ergebnissen und geringem Chemikalieneinsatz führt zur Ableitung der Redoxreihe der Metalle und ergänzt das einführende Egg Race.
Wie schon beim Egg Race werden hier die aus dem Lernmittelhandel bekannten Sets mit Metallblechen für Zn, Fe, Cu und Ag verwendet. Die im Set noch enthaltenen Bleibleche werden vom Lehrer vorher entnommen. Mit ihnen sind keine Schülerversuche zulässig.
Das Arbeitsblatt für das Praktikum (siehe
e021 ) wird laminiert ausgegeben und ist somit oft wiederverwendbar. Nach
Auflegen der Bleche und Auftropfen der Lösungen ergibt sich ein ästhetisches
Bild. Der Versuch selbst ist einfach und schnell vorzubereiten und dauert nur
wenige Minuten.
Der Heftaufschrieb erfolgt nach dem Unterrichtsgespräch und der Auswertung an der Tafel. Hier können einfache Redoxreaktionen besprochen, das Formulieren von Reaktionsgleichungen und die Zuordnung zentraler Fachbegriffe/Begriffspaare geübt werden:
Oxidation:
Elektronenabgabe
Reduktion:
Elektronenaufnahme
Oxidationsmittel:
Teilchen, das Elektronen aufnimmt
Reduktionsmittel:
Teilchen, das Elektronen abgibt
Korrespondierendes Redoxpaar:
reduzierte und oxidierte Form
Das Aufstellen einer Ordnung der Redoxpaare nach Stärke der Reduktionsmittel bzw. Oxidationsmittel bildet einen Höhepunkt der Stunde.
An der Reaktion von Zink mit Kupfer(II)-Ionen können die Vorgänge in der Obstbatterie nochmals thematisiert werden. Dort müssen Oxidation und Reduktion räumlich getrennt sein, damit es zu einem Elektronenfluss durch den Draht kommt.
Die Reaktion (Oxidation) von Zinkatomen zu Zink-Ionen am Minuspol wird klar. Für den Pluspol ergibt sich der Widerspruch, dass hier ja die oxidierte Form, also Kupfer(II)-Ionen, zur Reduktion nötig wäre, während das metallische Kupfer selber nicht reduziert werden kann. Es gibt dort aber keine Kupfer-Ionen, sondern nur das Metall. Dieses Problem muss noch offen bleiben – klar ist aber, dass am Pluspol eine Reduktion ablaufen muss. Da die Obstbatterie auch mit einem Graphitstab als Ableitelektrode funktioniert, muss diese Reduktion offensichtlich mit Stoffen aus dem Obst an der Oberfläche der Graphitelektrode ablaufen.

Lehrerinformation: Herunterladen [doc] [95 KB]
Lehrerinformation: Herunterladen [pdf] [113 KB]
