Atombau bis Ionengitter
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
|
Aufgabe 1 : Was stinkt denn hier?! |
Ü3 |
Ziel:
Diese Aufgabe wendet das Wissen und die Strategien der Unterrichtseinheit an
einem Beispiel an.
 Arbeite mit einem Partner zusammen.
Arbeite mit einem Partner zusammen.
Als Stinkspat bezeichnet man eine dunkelviolette bis schwarze Form des Fluorits, die beim Zerkleinern einen stechenden Geruch entwickelt. Der Geruch wird durch sehr geringe Mengen von gasförmigem Fluor (F 2 ) verursacht. Stinkspat kommt oft zusammen mit Uranmineralien vor, die teilweise als feinste Partikel im Stinkspat eingeschlossen sein können. Die besondere Eigenschaft des Stinkspates hat ihre Ursache in der radioaktiven Bestrahlung des Fluorits. Die bekannteste deutsche Fundstelle ist Wölsendorf in der Oberpfalz.
- Wiederholt die Arten radioaktiver Strahlung und erklärt sie euch gegenseitig.
-
Beim radioaktiven Zerfall wird Gammastrahlung frei, aus einzelnen Fluorid-Ionen
ein Elektron freisetzen kann. Dabei bildet sich ein Fluor-Atom im Ionengitter.
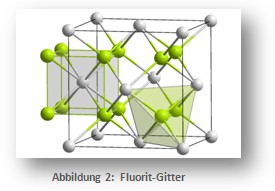
Stellt diesen Vorgang vereinfacht im Schalenmodell dar. - Bestimmt die Koordinationszahlen der Ionensorten im Fluorit-Gitter.
- Das Metall-Ion des Fluorit-Gitters hat die Massenzahl 40. Gebt die Verhältnisformel von Fluorit an und benennt die Verbindung systematisch.
- Sehr schwere Zusatzaufgabe: Begründet die Verhältnisformel anhand der grau begrenzten Elementarzelle des Kristallgitters. Die vier grün dargestellten Ionen außerhalb werden hier vernachlässigt.
Abbildung 1 (CC): http://commons.wikimedia.org/wiki/File:Fluorite-191782.jpg
Abbildung 2 (CC): http://commons.wikimedia.org/wiki/File:CaF2_polyhedra.png
|
Aufgabe 2 : Nichts als Fehler? |
Ü3 |
Ziel:
Kannst Du erkennen, ob es sich um eine Ionenverbindung handeln kann? Ist die
Verhältnisformel richtig? Falls es sich um Ionenverbindungen handelt, sind diese
aus einfachen Ionen von Hauptgruppenelementen aufgebaut.
Entscheide, ob die Verhältnisformel richtig oder falsch ist, korrigiere sie
gegebenenfalls und begründe die Entscheidung anhand des PSE:
- Ca 2 Cl b. NaF c. SCl d. Al 3 O 4
Weiter zur Lösung
Atombau-Ionengitter: Herunterladen [docx] [174 KB]