Neutralisation
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
| Neutralisation / Übungen mit der „Becherglasmethode“ |
Ü1
|
Demonstrationsexperiment
Geräte und Chemikalien:
- Becherglas 400 mL hohe Form mit 150 mL Salzsäure (c = 0,1 mol · L -1 ) und einigen Tropfen Phenolphthalein-Indikator-Lösung (w ˂ 1%)
- Becherglas 400 mL hohe Form mit 100 mL Natronlauge (c = 0,1 mol · L -1 )
Durchführung:
Die Salzsäure wird mit kreisendem Flüssigkeitsstrahl langsam in die Natronlauge
gegossen.
(weißer Kontrasthintergrund oder Unterleuchtung des Becherglases mit Natronlauge)

Beobachtungen:
- Versuchsbeginn: Beide Lösungen sind farblos.
- Bei Zugabe von Salzsäure mit Indikator färbt sich die Lösung sofort rotviolett. (???)
- Nach Zugabe von etwa 100 mL Salzsäure entfärbt sich die Lösung schlagartig wieder.
-
Versuchsende: Die gesamte Salzsäureportion ist zugegeben.
Die Lösung im unteren Becherglas ist farblos.
Fachdidaktischer Kommentar / Befähigungsziele:
Das Experiment bietet zunächst einen überraschenden Effekt, der aber mit
Vorwissen zum Thema Säure-Base-Reaktion/Neutralisation auf Teilchenebene gedeutet
werden kann.
Die Schülerinnen und Schüler üben das genaue Beobachten und das Verknüpfen von beobachtbaren Phänomenen (Stoffebene) mit Deutungen auf Teilchenebene. Der Wechsel von der Stoff- zur Teilchenebene wird durch die Darstellung der Bechergläser in beiden Betrachtungsebenen erleichtert.
Bewusst wird bei der Übungsaufgabe eine andere Darstellung als die übliche Schreibweise in Reaktionsgleichungen gewählt. Der Umgang mit den Formeln der typischen Teilchen saurer und alkalischer wässriger Lösungen wird eingeübt. Einfaches Abzählen von Teilchen im unteren Becherglas ermöglicht die Zuordnung der einzelnen Phasen des Experiments zu den Begriffen alkalische Lösung, neutrale Lösung, saure Lösung und führt Betrachtungen auf Teilchenebene wieder zurück auf die stoffliche Ebene. Die Verwendung von Fachbegriffen wird dabei geübt.
Ziel:
Du kannst nach dieser Übung
- Beobachtungen mit Hilfe von Vorgängen auf Teilchenebene deuten,
- den Zusammenhang zwischen einem Überschuss von Oxonium-Ionen und dem Begriff „ saure Lösung “ beschreiben,
- den Zusammenhang zwischen einem Überschuss von Hydroxid-Ionen und dem Begriff „ alkalische Lösung “ beschreiben,
- die Neutralisationsreaktion als Reaktion von Oxonium-Ionen und Hydroxid-Ionen zu Wassermolekülen erklären.
Aufgabe:
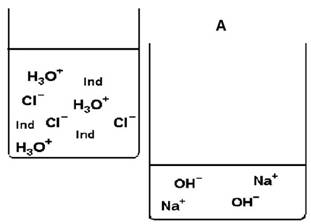
In der Tabelle siehst du eine vereinfachte Schemadarstellung der Ausgangssituation des Versuchs (A) auf Teilchenebene.
Beim Umgießen gelangen immer mehr Teilchen vom linken in das rechte, untere
Becherglas. Welche und wie viele das sind, kannst du sehen, wenn du den Restinhalt
der linken Bechergläser vergleichst.
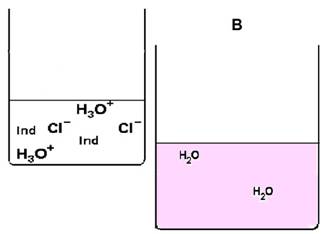
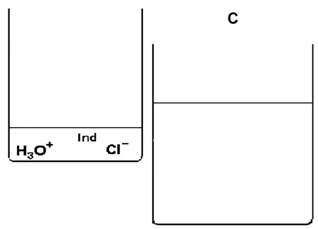
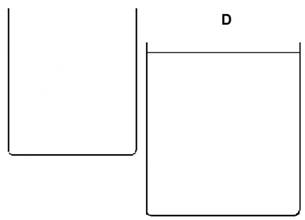
Diese Teilchen reagieren zum Teil miteinander. Bei (D) ist der Versuch beendet.
Ergänze in der Tabelle ab (B) die jeweiligen Teilchen (Formel, richtige Anzahl) im rechten, unteren Becherglas.
Vervollständige die Angaben in der rechten Spalte mit den passenden Begriffen / Fachbegriffen.
TIPP 1
Die Gesamtzahl der Teilchen ändert sich hier nicht. In jeder Phase A-D sind
3 Indikatorteilchen (Ind) und 10 weitere Teilchen auf die beiden Bechergläser
zu verteilen.
|
|
Im rechten, unteren Becherglas befindet sich ein Überschuss von ………………………………..-Ionen. Es ist eine ………………………………...Lösung. Die Lösung ist farblos, weil noch ……….. …………………………………………………………… |
|
|
Im rechten, unteren Becherglas befindet sich ein Überschuss von ………………………………..-Ionen. Es ist eine ………………………………...Lösung. Phenolphthalein färbt die Lösung …………………………………………………… |
|
|
Im rechten, unteren Becherglas befindet sich …………….Überschuss von ………………… oder ……………..……..-Ionen. Es ist eine ………………………………...Lösung. Phenolphthalein färbt die Lösung ……….. |
|
|
Im rechten, unteren Becherglas befindet sich ein Überschuss von ………………………………..-Ionen. Es ist eine ………………………………...Lösung. Phenolphthalein färbt die Lösung ……….. |
Neutralisation: Herunterladen [docx] [345 KB]