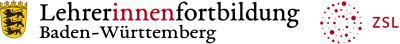Über die Größe der Atome
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Ist es dir gelungen, die Größe eines Kohlenstoffatoms zu berechnen?
Falls nicht, beachte das elektronenmikroskopische Bild von den Kohlenstoffatomen.
Es enthält einen Maßstabsbalken mit der Angabe 0,5 nm. Der Balken
hat etwa die dreifache Länge eines Atomdurchessers. Damit ergibt sich für
das Kohlenstoffatom ein Durchmesser von etwa 0,16 nm und ein Atomradius rA von
0,08 nm.
In der wissenschaftlichen Literatur findet man für den Radius des Kohlenstoffatoms
einen Wert von 0,076 nm.
Das ist ja nun wirklich sehr klein, den 0,076 nm sind nur 0,000000000076 m.
Um solche unhandlichen Zahlen zu schreiben verwendet ein Wissenschaftler Exponenten.
![]()
Bereits 1805 hat DALTON eine Liste mit Atommassen verschiedener Elemente veröffentlicht, allerdings noch mit vielen Fehlern. Erst dem genialen schwedischen Experimentalchemiker BERZELIUS gelang die Gewinnung reiner Elemente aus Verbindungen (Elementaranalyse) und die Bestimmung ihrer Atommassen relativ zum leichtesten und kleinsten Atom, dem Wasserstoffatom. Dessen Atommasse gab er den Wert 1.
Heute geben wir die Masse von 1 Wasserstoffatom als eine Masse von 1 u an (u = Atommasseneinheit).
Außerdem führte Berzelius die chemischen Symbole für Atome und Verbindungen ein, die wir auch heute noch verwenden.
Beispiele
Aufgaben:
1 Wie viele Wasserstoffatome benötigt man, um eine Masse von einem Gramm zu erhalten?
2 Das Volumen eines Atoms lässt sich mit folgender Formel berechnen:
![]()
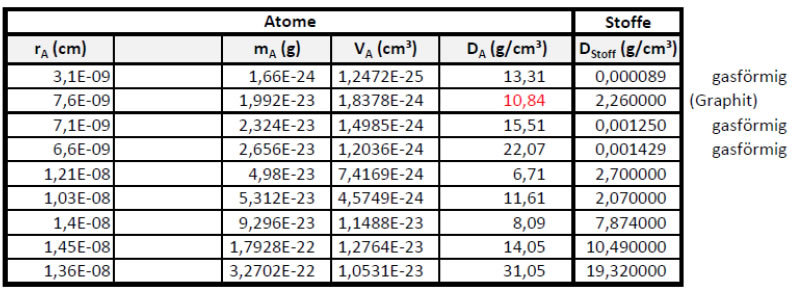
Welches Element in der Tabelle hat die Atome mit der größten Dichte?
3 Für gewiefte Rechner und Denker: Berechne die Dichte eines Kohlenstoffatoms und vergleiche sie mit dem Wert für die Dichte von Graphit.
![]()
Finde eine Erklärung für die Differenz.
Die Atommasseneinheit 1 u
Wie die Kleinheit der Atome vermuten lässt, ist auch deren Masse extrem klein:
1u = 0,00000000000000000000000166 g oder
1u = 1,66 * 10-24 g = 1,66 * 10-27 kg
Umrechnung Atommasseneinheiten in g:
1u = 1,66 * 10-27g
Ergebnis:
Atome sind dichter als Stoffe, denn Stoffe bestehen aus Teilchen und Leere!
Über die Größe der Atome: Herunterladen [doc] [46 KB]
Über die Größe der Atome: Herunterladen [pdf] [281 KB]