Lösungen zum Springbrunnenversuch
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Einen Springbrunnen mit Wasser in einem abgeschlossenen Gefäß kann man immer dann herstellen, wenn in dem Gefäß ein Gas enthalten ist, welches sich sehr gut in Wasser löst. Von Ammoniakgas, mit dem wir uns heute beschäftigen, lösen sich etwa 1150 l in 1 l Wasser (bei 0°C).
1. Führe zunächst in deiner Gruppe folgenden Versuch durch:
Versuch:
 Geräte: Chemikalien:
Geräte: Chemikalien:
2 trockene Reagenzgläser Ammoniakgas (T, N)
Reagenzglasständer Universalindikatorlösung
Gummistopfen mit Glasdüse
1 pneumatische Wanne
1 Leitfähigkeitsmessgerät
Schutzbrillen
Durchführung:
Füllt die Wanne zu ¾ mit Wasser. Gebt zehn Tropfen Universalindikator-Lösung hinzu. Befüllt unter Aufsicht eures Lehrers im Abzug ein trockenes Reagenzglas mit Ammoniakgas. Setzt sofort den Stopfen mit der Glasdüse so auf, dass die Düsenspitze in das Reagenzglas zeigt und verschließt die Glasdüse mit dem Daumen. Haltet die Glasdüse zunächst verschlossen unter das Wasser in der Wanne, lasst in die Glasdüse etwas Wasser eindringen, verschließt sie wieder mit dem Daumen und bringt das Wasser durch schütteln in das Reagenzglas. Haltet das Reagenzglas nun senkrecht mit der Glasdüse ins Wasser und lasst den Daumen los. Falls der Versuch nicht gelingen sollte, nehmt das zweite trockene Reagenzglas und verfahrt nochmals wie oben beschrieben. Testet anschließend die Leitfähigkeit der im Reagenzglas entstandenen Lösung.
Aufräumen:
Säubert die verwendeten Geräte und räumt alle Geräte und Chemikalien wieder an ihren Platz auf dem Lehrertisch zurück.
2. Notiere deine Beobachtungen:
- Wasser sprudelt ins Reagenzglas und färbt sich blau.
- Die Lösung leitet den Strom
Lösungen zum Lückentext
Auf Stoffebene betrachtet entsteht beim Lösen von Ammoniakgas in Wasser eine alkalische Lösung: Ammoniakwasser . Da diese den elektrischen Strom leitet , liegen in der Lösung Ionen vor.
Auf Teilchenebene betrachtet reagieren die Wassermoleküle mit den Ammoniak-Molekülen zu Ionen. Dabei geht ein Proton aus dem Wassermolekül zum Ammoniakmolekül über.
Reaktionsgleichung (in Strukturformeln):
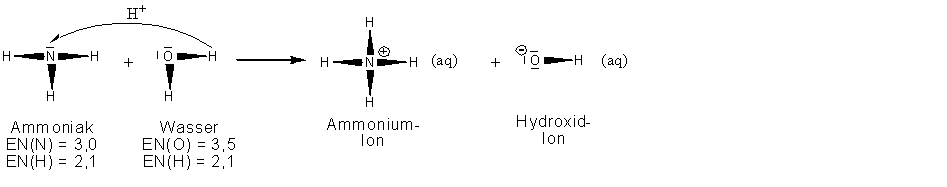
Reaktion ist eine
Protonenübergangsreaktion
.
Protonendonator:
Wasser
Protonenakzeptor:
Ammoniak
Formuliere eine Reaktionsgleichung für die Hypothese, dass das Proton vom Ammoniakmolekül zum Wassermolekül übergeht. Erkläre mittels deiner Versuchsbeobachtungen, dass diese Reaktion nicht stattfindet.
NH 3 + H 2 O → NH 2 - + H 3 O +
Lösung müsste sich hellrot färben.
Alle alkalischen Lösungen enthalten Hydroxidionen (OH - - Ionen).
Lösungsblätter: Herunterladen [doc] [87 KB]
