Lösungen: Protolyse am Beispiel der Salzsäure
Aufgabe 1:
Zum Wassermolekül:
Sauerstoffatome besitzen eine höhere Elektronegativität als Wasserstoffatome und ziehen deshalb die Bindungselektronen stärker an. Die Ladungsdichte erhöht sich deshalb beim Sauerstoffatom, man teilt ihm eine negative Partialladung zu. An dem Wasserstoffatom erniedrigt sich die Elektronendichte, sie erhalten eine positive Partialladung. Da die beiden nicht bindenden Elektronenpaare des Sauerstoffatoms einen größeren Platzbedarf haben, ist das Wassermolekül gewinkelt: positiver und negativer Ladungsschwerpunkt fallen nicht zusammen. Somit ist das Wassermolekül ein Dipolmolekül.
Zum Chlorwasserstoffmolekül:
Das Chloratom besitzt eine höhere Elektronegativität als das Wasserstoffatom und zieht deshalb die Bindungselektronen stärker an. Die Ladungsdichte erhöht sich deshalb am Chloratom, man teilt ihm eine negative Partialladung zu. Am Wasserstoffatom erniedrigt sich die Elektronendichte, es erhält eine positive Partialladung. Das Molekül ist linear aufgebaut und die Ladungsschwerpunkte fallen nicht zusammen. Es liegt ein Dipolmolekül vor.
Aufgabe 2:
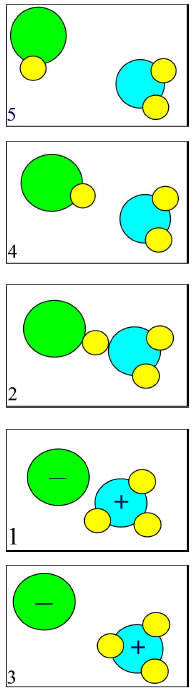 Moleküle nähern sich,
noch keine Orientierung.
Moleküle nähern sich,
noch keine Orientierung.
Moleküle nähern sich weiter an. Orientierung aufgrund der Anziehung durch die unterschiedlichen Partialladungen.
Moleküle treten in Wechselwirkung. Ein Proton wandert zum Chlorwasserstoffmolekül.
Ein negatives Chloridion und ein positives Oxoniumion sind entstanden.
Die Ionen werden sofort aquatisiert.
Lösungen: Herunterladen [doc] [322 KB]
Lösungen: Herunterladen [pdf] [174 KB]
