Ansatz 2
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Hinweis
Es wird darauf hingewiesen, dass für jedes Experiment entsprechend der eigenen Durchführung vor der erstmaligen Aufnahme der Tätigkeit eine Gefährdungsbeurteilung durchgeführt und dokumentiert werden muss. Jede fachkundige Nutzerin/jeder fachkundige Nutzer muss die aufgeführten Inhalte eigenverantwortlich prüfen und an die tatsächlichen Gegebenheiten anpassen.
Weder die Redaktion des Lehrerfortbildungsservers noch die Autorinnen und Autoren der veröffentlichten Experimente übernehmen jegliche Haftung für direkte oder indirekte Schäden, die durch exakten, veränderten oder fehlerhaften Nachbau und/oder Durchführung der Experimente entstehen. Weiterführende Informationen erhalten Sie unter www.gefahrstoffe-schule-bw.de
SV: Die Zersetzung von Wasser in die Elemente
Vorabinformationen:
 Wasser hat die chemische Formel H
2
O und gehört zu den leichtflüchtigen Stoffen. Es ist eine Verbindung der Elemente Wasserstoff (Elementsymbol H) und Sauerstoff (Elementsymbol O).
Wasser hat die chemische Formel H
2
O und gehört zu den leichtflüchtigen Stoffen. Es ist eine Verbindung der Elemente Wasserstoff (Elementsymbol H) und Sauerstoff (Elementsymbol O).
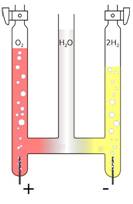
Wasser kann mit Elektrizität in die Elemente Wasserstoff (Molekülformel H 2 ) und Sauerstoff (Molekülformel O 2 ) zerlegt werden.
Historisch gelang dies im 19. Jahrhundert dem Chemiker August Wilhelm von Hofmann mit dem nach ihm benannten Hofmann’schen Wasserzersetzer (schematische Abbildung s. rechts). Wichtig war hierbei die Trennung der sich bildenden Gase Wasserstoff und Sauerstoff, da diese explosionsartig miteinander reagieren können.
Heute kann dieses Experiment sehr einfach mit Hilfe eines Elektrolyseurs durchgeführt werden.
Wasser wird bei einer Spannung von 2,00 V
elektrolysiert
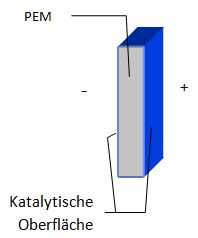
. Wichtigstes Bauteil des Elektrolyseurs ist die
PEM
(
P
roton
E
xchange
M
embrane). Die Oberfläche der PEM ist mit einem Katalysator (hier: Edelmetalle) belegt. Die Gase Wasserstoff und Sauerstoff werden in getrennten Gasbehältern gesammelt.
Sicherheitshinweise:
Bei dem Versuch entsteht Wasserstoff, der mit Sauerstoff oder Luft explosive Gemische bilden kann. Daher ist immer darauf zu achten, dass die Schlauchverbindungen richtig angebracht sind und stabil sitzen. Auch dürfen sich keine Zündquellen in der Nähe der Apparatur befinden. Bei der elektrischen Verschaltung muss auf die richtige Polung von Akku und Elektrolyseur geachtet werden.
Materialien:
 Elektrolyseur, Wasser (demineralisiert bzw. entsalzt), Schlauchverbindungen, 2 Spezial-Kabel mit zwei unterschiedlich großen Steckern, 2 Ausgleichsbehälter (evtl. bereits auf die Gasspeicher geschraubt) , Akku (2,0 V).
Elektrolyseur, Wasser (demineralisiert bzw. entsalzt), Schlauchverbindungen, 2 Spezial-Kabel mit zwei unterschiedlich großen Steckern, 2 Ausgleichsbehälter (evtl. bereits auf die Gasspeicher geschraubt) , Akku (2,0 V).
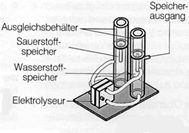
Der Elektrolyseur:
Die Abb. rechts zeigt den Aufbau des Elektrolyseurs mit Gas-Speichertanks sowie Bezeichnung der einzelnen Bauteile.
Durchführung
- Befestige – falls nicht bereits geschehen – die Gasleitungen an den Ausgangsanschlüssen der Speichertanks.
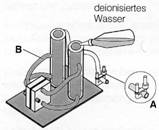
- Schließe die Ausgangsventile (A) mit Schlauchklemmen (Alternativ: Holzklammern).
- Befülle die Speichertanks bis zur Markierung –A– mit demineralisiertem Wasser.
- Drücke die oberen Silikonschläuche (B) mehrmals zwischen zwei Fingern, bis sie mit Wasser gefüllt sind.
- Fülle demineralisiertes Wasser in die Speichertanks nach, wenn der Wasserspiegel unter die Markierung –A– gesunken ist.
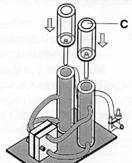
- Setze die Ausgleichsbehälter (C) auf die Speichertanks. Der Wasserspiegel soll an den Ausgleichsbehälter angrenzen. Wenn dies nicht der Fall ist, öffne kurz das Ausgangsventil.
Bitte die Apparatur von der Lehrkraft kontrollieren lassen!
-
Schließe einen Akku (2,0 V) mit den zugehörigen Spezialkabeln (zwei verschiedenen Steckergrößen) an den Elektrolyseur an.
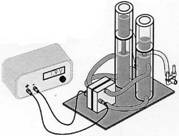 Achte dabei auf die richtige Polung!!!
Achte dabei auf die richtige Polung!!!
- Trenne die Kabelverbindung, sobald einer der beiden Speicher voll ist, d.h. das Gasvolumen die untere Markierung erreicht.
Auswertung:
- Notiere Deine Beobachtungen.
- Notiere die Reaktionsgleichung der ablaufenden Elektrolyse.
-
In welchem Volumenverhältnis bilden sich die beiden Gase?
- Fülle das Gas, das sich am positiven Anschluss des Elektrolyseurs gebildet hat in ein kleines Reagenzglas, indem du dieses über den Schlauch von unten befüllst und bestätige, dass es sich hierbei um Sauerstoff handelt.
- Fülle das Gas, das sich am negativen Anschluss des Elektrolyseurs in ein kleines Reagenzglas, in dem du das Gas von unten in das kleine Reagenzglas füllst und anschließend mit dem Daumen zuhältst. Entzündet den Gasbrenner und führt das Reagenzglas mit der Öffnung zur Brennerflamme (Öffnung nach unten halten, Daumen kurz vor der Flamme von der Öffnung entfernen). Diese Probe wird Knallgasprobe genannt.
- Stelle den HOFMANN’schen Wasserzersetzer und den Elektrolyseur gegenüber. Kennzeichne in beiden sich entsprechende Apparaturteile.
- Erstelle je einen Steckbrief von Wasserstoff und Sauerstoff.
- An welchem Akku-Anschluss (Plus- oder Minuspol) entsteht welches Gas?
- Erkläre, wieso die Reagenzgläser zur Identifizierung der Gase wie oben beschrieben befüllt werden.
Aufgaben
- Wasser bildet sich bei der Reaktion der Elemente Wasserstoff und Sauerstoff. Gib die Reaktionsglei-chung bei der Bildung von Wasser aus den Elementen an.
- Begründe, in welchem Volumenverhältnis reagieren die Gase Wasserstoff und Sauerstoff zu Wasser?
- Berechne aus dem Volumenverhältnis das Massenverhältnis, in dem Wasserstoff und Sauerstoff zu Wasser reagieren. Hierzu sind nachfolgende Dichte-Werte für die Elemente Wasserstoff und Sauerstoff angegeben. Kläre vorab mit deinem Praktikumspartner die Begriffe Standard- und Normbedingungen.
- Begründe, wieso die Gasdichte von Sauerstoff und Wasserstoff unter Normbedingungen größer ist als unter Standardbedingungen.
- Berechne das Massenverhältnis für Norm- bzw. Standardbedingungen. Begründe das Ergebnis.
- Berechne das Volumen an Wasserstoff, das zur vollständigen Umsetzung von 5 Liter Sauerstoff benötigt wird (SB). Wie viel Gramm Wasser bilden sich bei der Reaktion?
- Beschreibe, wie Wasser chemisch nachgewiesen werden kann.
- Ein Physiker möchte nachweisen, dass es sich bei einer farblosen Flüssigkeit um Wasser handelt. Erläutere physikalische Möglichkeiten der Untersuchung
- Berechne, wie viel Gramm Wasserstoff vollständig mit 1,5 kg Sauerstoff reagieren.
-
Wasserstoff wird immer wieder als Energieträger der Zukunft diskutiert.
- Diskutiere mit deinem Praktikumspartner, welche Vor- und Nachteile Wasserstoff als Energieträger hat und bereite ein Poster / Präsentation zur Vorstellung in der Klasse vor.
- Informiere Dich mit Hilfe geeigneter Quellen, wie Wasserstoff hergestellt werden kann.
- Diskutiere, ob demnach Wasserstoff ein möglicher Energieträger der Zukunft sein kann.
|
Element |
Sauerstoff |
Wasserstoff |
|
Dichte unter Standardbedingungen |
1,33 g/l |
0,0833 g/l |
|
Dichte unter Normbedingungen |
1,43 g/l |
0,0899 g/l |
Zersetzung von Wasser:
Herunterladen
[doc]
[373 KB]
Zersetzung von Wasser:
Herunterladen
[pdf]
[768 KB]
Arbeitsblatt: Zersetzung von Wasser:
Herunterladen
[doc]
[372KB]
Arbeitsblatt: Zersetzung von Wasser:
Herunterladen
[pdf]
[773 KB
