Volumen, Druck, Temperatur
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Ein Flüssigkeitsthermometer besteht aus einem flüssigkeitsgefüllten Gefäß mit aufgesetzter Kapillare (Steigrohr).
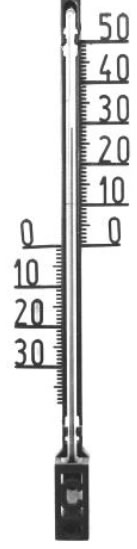 Als Füllung werden Stoffe verwendet, die im gewünschten Bereich flüssig sind und die eine zur Temperatur proportionale Ausdehnung zeigen. So lässt sich an dem Thermometer eine Skala anbringen, auf der man die Temperatur direkt ablesen kann.
Als Füllung werden Stoffe verwendet, die im gewünschten Bereich flüssig sind und die eine zur Temperatur proportionale Ausdehnung zeigen. So lässt sich an dem Thermometer eine Skala anbringen, auf der man die Temperatur direkt ablesen kann.
In einer Formel ausgedrückt gilt also:
Die Volumenzunahme des Stoffes ist proportional zu seiner Temperaturänderung:
![]()
|
Aber warum ist das so?
Durch eine Geschwindigkeitserhöhung steigt der Platzbedarf der Teilchen. Auf der Ebene der Teilchen führt dies zu einer Zunahme der Geschwindigkeit, Zunahme der Bewegungsenergie. Auf der Ebene der Stoffe führt dies zu einer Zunahme der Temperatur, Zunahme des Volumens |
Wenn also die Temperatur des Stoffes von der Geschwindigkeit der Teilchen abhängt, muss es eine tiefste Temperatur geben, denn es gibt ja auch eine niedrigste Geschwindigkeit, nämlich den absoluten Stillstand, die Geschwindigkeit null.
Wie groß ist die niedrigste Temperatur?
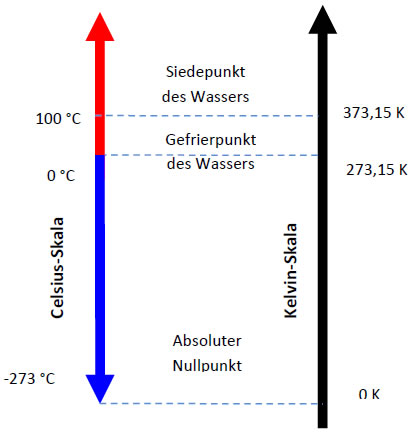 Sie beträgt -271,15°C, ist aber praktisch nie ganz erreichbar. Dieser absolute Tiefpunkt markiert auch den
absoluten Nullpunkt
der
absoluten Temperaturskala
, die in der Physik und in der Chemie vorzugsweise verwendet wird. Die Maßeinheit der absoluten Temperaturskala ist das
Kelvin (K)
.
Sie beträgt -271,15°C, ist aber praktisch nie ganz erreichbar. Dieser absolute Tiefpunkt markiert auch den
absoluten Nullpunkt
der
absoluten Temperaturskala
, die in der Physik und in der Chemie vorzugsweise verwendet wird. Die Maßeinheit der absoluten Temperaturskala ist das
Kelvin (K)
.
Eine Temperaturdifferenz von 1°C entspricht dabei einer Temperaturdifferenz von 1K.
Die Volumenzunahme (ΔV) bei Temperaturerhöhung (ΔT) ist besonders deutlich bei Gasen.
Hier gilt:
![]()
Das Volumen der Gase wird im Gegensatz zu Feststoffen und Flüssigkeiten auch noch sehr stark vom Druck beeinflusst.
Hierbei gilt:

In Worten klingt das viel anschaulicher:
Je größer der Druck, umso kleiner ist das Volumen eines Gases.
Gase sind also komprimierbar, d. h., sie können unter Druck zusammengepresst werden. Will man eine große Gasmenge in einem möglichst kleinen Gefäß unterbringen, so komprimiert man das Gas mit hohem Druck. Die Druckgasflaschen können bis zu 50 l Gas enthalten bei einem Druck von bis zu 300 bar.
Aufgabe:
Wie viele Liter Sauerstoff lassen sich bei Normaldruck aus einer vollgefüllten Sauerstoffflasche mit den oben genannten Daten entnehmen?
Dazu:
Informiere dich über die Druckeinheiten N/m², Pa, bar. Welcher Zusammenhang besteht zwischen den verschiedenen Einheiten? Wie groß ist der Normaldruck in den verschiedenen Einheiten?

Verschiedene Druckgasflaschen. Die Farbenkombinationen (Flasche/Schulter) markieren verschieden Gase. grau/weiß steht z. B. für Sauerstoff, rot/rot für Wasserstoff.
Arbeitsblatt Volumen, Druck, Temperatur:
Herunterladen
[doc]
[793 KB]
Arbeitsblatt Volumen, Druck, Temperatur:
Herunterladen
[pdf]
[414 KB]