Entropie, Temperatur und Masse
Infobox
Diese Seite ist Teil einer Materialiensammlung zum Bildungsplan 2004: Grundlagen der Kompetenzorientierung. Bitte beachten Sie, dass der Bildungsplan fortgeschrieben wurde.
Aufgabe 1:
(Umgang mit Schaubildern und unbekannten Formeln, funktionale Zusammenhänge erkennen)
Folgendes Schaubild (Schaubild 1) zeigt den Zusammenhang zwischen dem Entropiegehalt und der Temperatur von 1 kg Wasser.
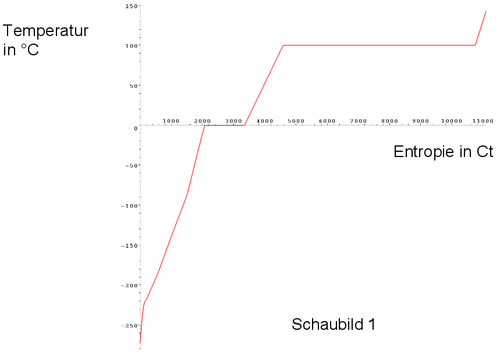 Hinweis: Es gibt keine negativen Entropiewerte.
Hinweis: Es gibt keine negativen Entropiewerte.
Schaubild 2 zeigt den Zusammenhang zwischen dem Entropiegehalt und der Temperatur von 1 kg Kupfer.
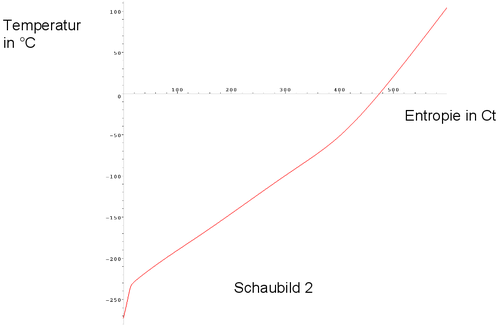
- Beschreibe den Verlauf obiger Schaubilder.
-
Interpretiere das Verhalten des Schaubildes
Entropiegehalt von 1 kg Wasser
bei den Temperaturen 0 °C und 100 °C. -
Formuliere unter Einbeziehung obiger Schaubilder eine Vermutung über den Zusammenhang zwischen der Temperatur und dem Entropiegehalt eines Gegenstandes. Verwende hierbei die Formulierungen:
Je größer ..., desto...
oderJe kleiner ..., desto ...
. -
Finde Argumente, die folgende Aussage unterstützen:
Ein Gegenstand kann nicht unter -273 °C abgekühlt werden.
In einer Formelsammlung findet man folgende Formel für den Entropiegehalt S einer Stoffportion mit Masse m:
S = S 1 ·mHierbei entspricht S 1 dem Entropiegehalt von 1 kg dieses Stoffes. S 1 hat die Einheit 1 Ct/kg.
- Bestimme die Entropie von 17,5 kg Wasser bei den Temperaturen: -20 °C, 20 °C und 110 °C.
- Bestimme die Entropie von 35 kg Wasser bei den Temperaturen: -20 °C, 20 °C und 110 °C.
- Bestimme die Entropie von 17,5 kg Kupfer bei den Temperaturen: -20 °C, 20 °C und 110 °C.
- Beurteile, ob der Entropiegehalt eines Stoffes proportional zu seiner Masse ist.
-
Zeichne in ein gemeinsames Achsenkreuz folgende zwei Schaubilder:
- Entropiegehalt von Wasser in Abhängigkeit von der Masse bei einer Temperatur von 20 °C
- Entropiegehalt von Wasser in Abhängigkeit von der Masse bei einer Temperatur von 110 °C
Aufgabe 2:
(Fachkenntnisse: Eigenschaften der Entropie)
Kreuze die richtigen Aussagen an. Verbessere die falschen Aussagen. Tipp: Aufgabe 1.
| Aussage | wahr |
|---|---|
| Je höher die Temperatur eines Gegenstandes, desto mehr Entropie enthält der Gegenstand. | |
| Je kleiner die Wassermenge, desto mehr Entropie enthält sie. | |
| Der Entropiegehalt von Kupfer ist proportional zu seiner Masse. | |
| Kühlt sich ein Gegenstand ab, dann nimmt seine Entropie zu. | |
| Wird ein Gegenstand von außen erwärmt, dann strömt Entropie von außen in den Gegenstand hinein. Kühlt sich ein Gegenstand ab, dann gibt er Entropie an die Umgebung ab. | |
| Der Entropiegehalt eines Gegenstandes hängt von der Temperatur, der Masse und dem Material des Gegenstandes ab. | |
| Wenn zwei Gegenstände mit unterschiedlichen Temperaturen in Kontakt stehen, dann strömen Entropie und Energie vom Gegenstand A mit höherer Temperatur zum Gegenstand B mit niederer Temperatur. Folglich nimmt die Entropie und Energie des Gegenstands A ab und die Energie und Entropie des Gegenstands B zu. Dadurch kühlt sich Gegenstand A ab und Gegenstand B erwärmt sich. |
Entropie, Temperatur und Masse: Herunterladen [doc] [87 KB]
Entropie, Temperatur und Masse: Herunterladen [pdf] [130 KB]
